KF Technology srl
BSC
BSC
Gehirnschnittkammer: Interface und Submerged – BSC 3 – Membrankammer – MSC1 …
Das Design der BSC1-Kammer orientiert sich an der originalen „Oslo-Kammer“ (Langmoen & Andersen 1981) und wurde später modifiziert (Dhanjal & Sears 1980, Alger et al. 1984), um sowohl die Interface- als auch die Submerged-Methode der Schnitterhaltung zu ermöglichen. Diese Kammer lässt sich durch einfaches Verstellen des Flüssigkeitsstandes mittels eines Schraubverstellungselements anpassen, sodass beide Methoden der Schnitterhaltung – „Submerged“ und „Interface“ – mit demselben Gerät realisierbar sind. Die Gehirnschnitte werden auf einem abnehmbaren Einsatz gestützt, der individuell an Ihre Anforderungen angepasst werden kann. Standardmäßig wird ein Einsatz mit einem Nylon-Netz geliefert, der für beide Methoden geeignet ist.
Dieser Einsatz kann modifiziert oder maßgefertigt werden, um auch andere Präparate aufzunehmen, z. B. das Rückenmark bei Erwachsenen (Dhanjal & Sears 1980, Alger et al. 1984) oder Kleinhirnschnitte (Crepel et al. 1981).
Optionaler „Schrägeneinsatz“ für die Perfusion von Schnitten mit kleinem Totraum
In Experimenten, bei denen ein kleiner Totraum erforderlich ist (z. B. für einen schnellen Lösungstausch, den Einsatz kostspieliger Medikamente oder zur Gewinnung kleiner Volumina für ein Fraktionensammelsystem), ist ein schräger Einsatz erhältlich, der den herkömmlichen Netzeinsatz ersetzt. Dieser ist so konzipiert, dass das Perfusionsmedium an dem Schnitt vorbeifließt und gleichzeitig eine hohe Sauerstoffspannung oberhalb des Schnitts aufrechterhalten wird (Murphy et al. 1997, Bliss et al. 2003). Die Schräge leitet das Perfusionsmedium zu einem Auslassbecken, wo es gesammelt und zur Rezirkulation oder Analyse weiterverwendet werden kann.
Gehirnschnittkammer: Interface
- Interface-Methode der Schnitterhaltung
- Zwei Zuführungskanäle für das Perfusionsmedium
- Nutzung der gesamten Oberfläche für mehrere Schnitte oder Vorlagen
- Vorlagen mit Einzel- oder Doppelbecken; weitere Designs auf Anfrage verfügbar
- Die Vorlage für das Einzelbecken beinhaltet Anschlüsse für eine Temperatursonde und einen Erdungsdraht
- Ein proportionaler Temperaturregler (PTC03) mit geringem Geräuschpegel wird für die Beheizung verwendet (*separat erhältlich)
Diese Aufzeichnungskammer für Gehirnschnitte wurde entwickelt, um isolierte, lebende Gewebe in vitro im „Interface“-Modus zu erhalten und stabile elektrophysiologische Aufzeichnungen zu ermöglichen. Die Temperatur wird dabei durch ein proportional geregeltes Heizelement, den PTC03, kontrolliert (bitte separat bestellen).
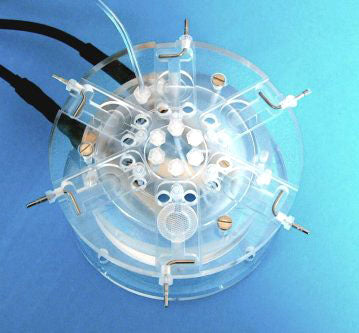
Der untere Bereich der Kammer ähnelt der BSC-1 hinsichtlich Temperaturkontrolle und Sauerstoffversorgung. Präoxygeniertes Medium tritt über zwei separate Leitungen in den Hauptteil der Kammer ein. Dabei kommen feinbohrige PTFE-Rohre zum Einsatz, die in dem beheizten, destillierten Wasser im unteren Kammerbereich spiralig verlaufen und in den oberen Bereich übergehen. Hier brechen eventuelle Luftblasen auf, sodass das Perfusionsmedium gleichmäßig zu den Schnitten fließt. Acrylvorlagen ermöglichen den Einsatz eines Einzelbeckens oder zweier separater Becken (andere Designs sind auf Anfrage erhältlich). Die Vorlagen werden auf der acrylischen Basis der Kammer positioniert, wobei Silikonschmierfett zur Abdichtung des Bodens verwendet wird (siehe Diagramm). Das typische Totraumvolumen beträgt ca. 200 µl im Einzelbecken, während in der Doppelversion jedes Becken etwa 100 µl aufweist. Die Länge der PTFE-Rohre, die das Perfusionsmedium zu den Becken transportieren, entspricht einem Volumen von ca. 400 µl. Die Durchflussrate des Perfusionsmediums wird am Auslassbecken mithilfe eines Linsentuchs geregelt, das dazu dient, die Lösung aus dem Auslass zu ziehen.
Durch Anpassen des „Überhangs“ wird die Durchflussrate effektiv reguliert, was die Eigenschaften des Flüssigkeitsmeniskus um die Schnitterparation bestimmt. Wie bei allen Interface-Präparationen wird die hohe Sauerstoffspannung durch das Einblasen eines Gasgemischs aus 95 % Sauerstoff und 5 % Kohlendioxid über einen Keramik-Diffusor im beheizten unteren Bereich der Kammer aufrechterhalten. Dieses befeuchtete und erwärmte Gasgemisch tritt über „Portlöcher“ in den oberen Kammerbereich ein und wird dort von einer Acrylabdeckung in Richtung der zentral angeordneten Schnitterparation gelenkt. Die Temperatur im oberen Kammerbereich wird gewährleistet, indem Medium und Gasgemisch in der erforderlichen Temperatur zugeführt werden – abhängig von der Temperatur des beheizten Kammerkörpers, der von einem Heizelement gesteuert wird, das wiederum vom proportionalen Temperaturregler PTC03 kontrolliert wird. Ein optionaler Monitorsensor ermöglicht es, die Temperatur im oberen Kammerbereich bei Bedarf zu überprüfen.
Der BSC3 ist in Versionen mit 2, 3, 4 und 6 Kanälen erhältlich und stellt eine Kreuzung zwischen den „Oslo“- und „Haas“-Typen der BSC1- und BSC2-Kammern dar. Diese Kammer ist hauptsächlich für pharmakologische Studien konzipiert, da bei vier oder sechs Kanälen gleichzeitig nur wenig Platz für Elektroden zur Verfügung steht.
Share